EVER Pharma erhält EU-Zulassung für Azacitidin, inklusive einer neuen Präsentation für eine effiziente Handhabung
EVER Pharma freut sich, die Erteilung einer EU-weiten Zulassung von Azacitidin anzukündigen, für die Behandlung von Patienten mit myelodysplastischem Syndrom, chronischer myelomonozytäre Leukämie und akuter myeloischer Leukämie1.
Azacitidin EVER Pharma ist in der Standard-Durchstechflasche mit 100 mg und einer neuen Durchstechflasche mit 150 mg erhältlich, um die Effizienz der Handhabung zu verbessern.
Azacitidin ist zu einem wichtigen Medikament bei der Behandlung von myelodysplastischem Syndromen geworden und bietet eine verbesserte Lebensqualität, sowie ein verbessertes Gesamtüberleben bei behandelten Patienten. Der weltweite Markt wird auf rund USD$760M geschätzt.
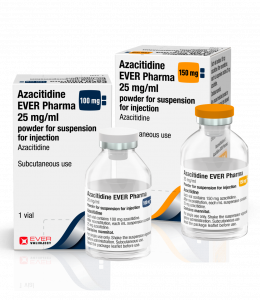
Die eingeschränkte Stabilität von flüssigem Azacitidin nach der Rekonstitution aus Pulver führt häufig dazu, dass Produktreste verworfen werden, wenn sie nicht sofort verwendet werden. Bei einer durchschnittlichen Patientendosis von weniger als 150 mg ist es häufig erforderlich, zwei der allgemein verfügbaren 100 mg Durchstechflaschen zu verwenden, um eine Patientendosis zu verabreichen, was zu einer möglichen Verschwendung von bis zu zwei Drittel der zweiten Durchstechflasche führt. Die neu eingeführte Durchstechflaschengröße von 150 mg von EVER Pharma bietet eine Patientendosis, die das Verschwendungspotential erheblich minimiert und die wertvolle Vorbereitungszeit verkürzt.
“Wir freuen uns, Azacitidin in unser wachsendes Portfolio innovativer EVER-Produkte aufzunehmen, die den Zugang der Patienten zu Krebstherapien verbessern. Da der weltweite Einsatz von Azacitidin jährlich um über 20% zunimmt, bietet EVER Patienten und medizinischem Fachpersonal jetzt ein erschwingliches Produkt und eine neuartige Präsentation mit Mehrwert, um die Vorbereitungszeit und die kostspielige Verschwendung zu minimieren” sagte Georges Kahwati, General Manager von EVER Pharma.
Azacitidin ist das dritte Onkologie Produkt von EVER Pharma, dass in den letzten 6 Monaten eine europäische Zulassung erhalten hat, und folgt den jüngsten Zulassungen von Cabazitaxel und Pemetrexed. EVER wird das Produkt in Europa und in anderen ausgewählten Ländern weltweit auf den Markt bringen.
1 Azactidin ist angezeigt zur Behandlung von erwachsenen Patienten, die für eine Transplantation hämatopoetischer Stammzellen (HSZT) nicht geeignet sind und eines der folgenden Krankheitsbilder aufweisen: (i) myelodysplastische Syndrome (MDS) mit intermediärem Risiko 2 oder hohem Risiko nach International Prognostic Scoring System (IPSS), (ii) chronische myelomonozytäre Leukämie (CMML) mit 10-29% Knochenmarkblasten ohne myeloproliferative Störung, (iii) akute myeloische Leukämie (AML) mit 20-30% Blasten und Mehrlinien-Dysplasie gemäß Klassifikation der World Health Organisation (WHO), (iv) AML mit > 30% Knochenmarkblasten gemäß WHO-Klassifikation.
